用NA表示阿伏加德罗常数,下列说有关说法正确的是( )
| A.在常温常压下,11.2L N2含有的分子数小于0.5NA |
| B.标准状况下,2.24L SO3含有的原子数为0.4NA |
| C.将1L 2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D.46g NO2和N2O4混合气体所含氧原子数目有可能为3NA |
下列溶液中有关物质的量浓度关系正确的是()
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
有Wn+、Xm+、Ym-、Zn-四种离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是
| A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大 |
| B.Y、Z的气态氢化物的热稳定性:YHm>HnZ |
| C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 |
| D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g);△H="+8.7kJ/mol"
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol
下列表示肼跟N2O4反应的热化学方程式,正确的是()
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7kJ/mol |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3kJ/mol |
| C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7kJ/mol |
D.N2H4(g)+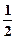 N2O4(g)= N2O4(g)=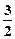 N2(g)+2H2O(g);△H=-1076.7kJ/mol N2(g)+2H2O(g);△H=-1076.7kJ/mol |
在KClO3+6HCl=KCl+3Cl2+3H2O反应中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为( )
| A.6:1 | B.5:1 |
C.1:3 | D.1:5 |
下列离子方程式正确的是()
| A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| B.三氯化铁溶液跟过量氨水反应:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+ |
| C.碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| D.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-=ClO3-+H2O |