2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型搞疟药青蒿素和双氢青蒿素。已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是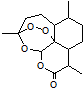
| A.分子式为C15H22O5 |
| B.能够发生水解反应 |
| C.每个分子中含有4个六元环 |
| D.青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是()
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形
C.若为A、B为同一主族元素,,则AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则AB3分子一定为NH3
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,可使湿润的红色石蕊试纸变蓝;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L。则下列说法不正确的是( )
| A.R在元素周期表中位置为第四周期VIII族 |
| B.Na2RO4水溶液可以用于杀菌消毒和净水 |
| C.1molY或Z与足量的R反应均转移2mol电子 |
| D.G为极性分子,中心原子采取sp2杂化 |
下列各项中,理由、结论及因果关系均正确的是()
| 选项 |
理由 |
结论 |
| A |
键能:N≡N>Cl-Cl |
单质沸点:N2>Cl2 |
| B |
元素的非金属性:N>P |
稳定性: NH3>PH3 |
| C |
分子中可电离的H+个数:H2SO4>CH3COOH |
酸性:H2SO4>CH3COOH |
| D |
氧化性:Fe3+>Cu2+ |
还原性:Fe2+>Cu |
下表为部分短周期元素化合价及其相应原子半径的数据。下列说法正确的是()
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径(nm) |
0.102 |
0.117 |
0.074 |
0.110 |
0.071 |
0.075 |
0.077 |
0.099 |
| 最高化合价 |
+6 |
+4 |
+5 |
+5 |
+4 |
+7 |
||
| 最低化合价 |
-2 |
-4 |
-2 |
-3 |
-1 |
-3 |
-4 |
-1 |
A.A的氢化物比C的氢化物稳定
B.F的氢化物与H的氢化物化合所得产物为离子晶体
C.F、G、H的最高价氧化物对应的水化物的酸性依次增强
D.B和G的最高价氧化物均为原子晶体
短周期元素X、Y、Z和W的原子序数依次增大。X原子的最外层电子数是内层电子数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2∶1。下列说法错误的是()
| A.XW4为非极性分子 |
| B.Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W |
| C.X、Y的最高价氧化物由固态转化为气态时,克服相同的作用力 |
| D.XW4、YW4、ZW2分子中的中心原子均为sp3杂化 |