碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。在高温下这两种化合物均能分解成氧化铜.溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是
| A.35g | B.30g | C.20g | D.15g |
下列各组离子能在溶液中大量共存的是
| A.Fe3+、H+、Cl-、SCN- | B.Fe2+、SO42-、H+、NO3- |
| C.Ba2+、HCO3-、Cl-、Na+ | D.K+、NH4+、SO42-、OH- |
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的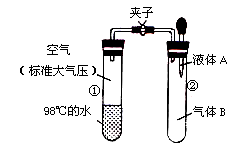
| A.蒸馏水、氯化氢 |
| B.盐酸、氨气 |
| C.石灰水、二氧化硫 |
| D.氢氧化钠溶液、一氧化碳 |
物质A里只有1×1022个同种分子,在这些分子里共含有2×1022个原子,那么A物质一定是
| A.单质 | B.化合物 | C.纯净物 | D.混合物 |
实验室中的药品常按物质的性质、类别不同而有规律的保管着。在做“酸的性质”实验时,实验桌上的部分药品的摆放如图所示。某同学取用KOH溶液以后应把它放回A、B、C、D四处中的
甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是
| A.Al2(SO4)3 | B.NaOH | C.BaCl2 | D.FeCl2 |