对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:(1)加热,放出的气体可以使品红溶液褪色;(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。对于下列微粒不能确认其在原溶液中是否存在的是( )
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
下列反应中是离子反应,又是氧化还原反应的是
A.Fe + CuSO4 =" Cu" + FeSO4 |
B.2Na +  Cl2 Cl2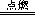 2 NaCl 2 NaCl |
C.NaCl + AgNO3 = AgCl↓ + NaNO3 + NaNO3 |
D.2KClO3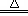 2KCl + 3O2↑ 2KCl + 3O2↑ |
下列各项实验操作和方法中,正确的是
| A.为加快过滤速度,可用玻璃棒在过滤器中搅拌 |
| B.可用坩埚蒸发浓缩CuSO4溶液 |
| C.分液漏斗和容量瓶使用前都需要检查是否漏液 |
| D.为了除去乙醇中的少量水,可直接蒸馏 |
用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应 ;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
| A.所消耗的硝酸的量:①>②>③ |
| B.对环境造成的危害,③最小 |
| C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是① |
| D.三种途径所消耗的铜的质量不相等 |
实现下列变化,必须加入氧化剂或还原剂的是
| A.NO2→HNO3 | B.NH4+→NH3 | C.Cl2 →HClO | D.NH3→NO |
如图进行实验,试管内装有12mLNO,然后间歇而缓慢地通入8mLO2。下面有关实验最终状态的描述正确的是
| A.试管内气体呈棕红色 | B.试管内气体为无色的NO |
| C.试管内气体为无色的O2 | D.试管内液面高度上升 |