已知水的电离方程式:H2O H++OH-,下列叙述中,正确的是
H++OH-,下列叙述中,正确的是
| A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG==lgc(H+)/c(OH—)。已知常温下某无色溶液的AG==12,则此溶液中大量共存的离子组是
| A.Na+、AlO2—、K+、NO3— |
| B.MnO4—、K+、SO42—、 Na+ |
| C.Mg2+ 、SO42—、 HCO3—、Na+ |
| D.NH4+、NO3—、 Al3+、Cl— |
下列叙述正确的是
| A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 |
B.溶液中c(H )越大,pH也越大,溶液的酸性就越强 )越大,pH也越大,溶液的酸性就越强 |
| C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 |
| D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
对于反应2X(g) + Y(g)  2Z(g),K表示平衡常数,下列说法正确的是
2Z(g),K表示平衡常数,下列说法正确的是
| A.当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 |
| B.随着反应正向进行,Z的浓度不断增大,X、Y的浓度不断减小,平衡常数不断增大 |
| C.温度发生变化,上述反应的K值也发生变化 |
| D.可逆反应达到平衡时,逆反应便立即停止了 |
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是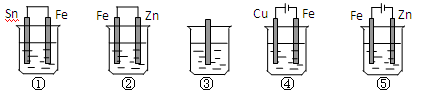
| A.①②③④⑤ | B.③②①⑤④ |
| C.⑤①③②④ | D.⑤②①③④ |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |