下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.1 mol·L-1NaCl溶液含有NA个Na+ |
| B.1 L 0.1 mol·L-1氨水含有0.1 NA个OH- |
| C.电解饱和食盐水若产生2 g氢气,则转移2 NA个电子 |
| D.将0.1 mol氯化铝溶于1 L水中,所得溶液含有0.1 NA个Al3+ |
分子式为C4H10O的醇催化氧化后能生成的醛有
| A.2种 | B.3种 | C.4种 | D.5种 |
为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验,其中操作顺序合理的是
①加入AgNO3溶液②加入NaOH溶液③加热④用HNO3酸化溶液
| A.①②③④ | B.②③④① | C.④③②① | D.②③①④ |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是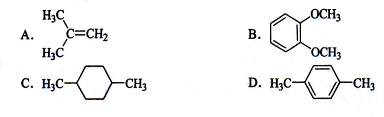
将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72升二氧化碳(标准状况下)和7.2克水, 下列说法正确的是
| A.一定有乙烯 | B.一定有甲烷 | C.一定没有甲烷 | D.可能有乙烷 |
下列物质中存在顺反异构体的是
| A.2-氯丙烯 | B.丙烯 | C.2-丁烯 | D.1-丁烯 |