由铁红、铁粉和氧化亚铁组成的混合物中加入300mL1 mol•L-1的盐酸,恰好使混合物完全溶解,并放出672mL气体(标准状态),往得到的溶液中加入硫氰化钾溶液不显红色,则下列判断中不正确的是
| A.混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol |
| B.往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 |
| C.n(Fe)<n(Fe2O3) |
| D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1:2 |
可逆反应aA(s) + bB(g) cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
cC(g) + dD(g) ; △H="=Q" KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是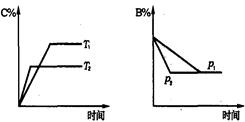
| A.T1<T2,Q>0 |
| B.Pl<P2,b==c+d |
| C.Tl>T2,Q<0 |
| D.P1<P2,a+b==c+d |
据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是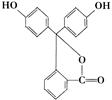
| A.酚酞的分子式为C20H14O4 |
| B.酚酞可与FeCl3溶液发生显色反应 |
| C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2 |
| D.1 mol酚酞与NaOH溶液共热,最多可消耗3 mol NaOH |
下列离子方程式书写正确的是
A.碳酸氢钾水解:HCO3—+H2O  H3O++CO32— H3O++CO32— |
| B.向硝酸银溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
| C.浓度均为0.1mol·L-1的氢氧化钡溶液与碳酸氢铵溶液等体积混合Ba2++2OH-+NH4++ HCO3—=BaCO3↓+NH3·H2O+H2O |
| D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
设阿伏加德罗常数为NA,下列说法正确的是
| A.1mol Cl2与足量Fe反应,转移的电子数为3NA |
| B.20g重水(D2O)中含有的中子数为8 NA |
| C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
| D.标准状况下,22.4L已烷中共价键数目为19NA |
下列是某学生自己总结的一些规律,其中正确的是
| A.氧化物不可能是还原产物,只可能是氧化产物 |
| B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知溶解度Mg(OH)2> Mg(HCO3)2 |