常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
| A.1:1 | B.108:1 | C.5×109:1 | D.1010:1 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是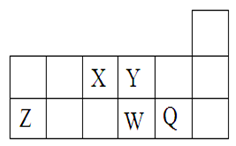
| A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+) |
| B.元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
② NH3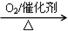 NO
NO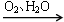 HNO3
HNO3
③NaCl(饱和)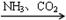 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3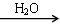 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
某实验过程如图所示,则图③试管中的现象是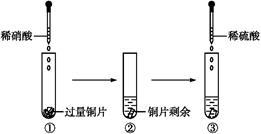
| A.铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B.铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象,因稀硫酸不与铜反应 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.1mol甲基(-CH3)含有9NA个电子 |
| B.标准状况下,22.4LSO3含有的原子数为4NA |
| C.0.10mol.L-1NaOH溶液中含有OH-离子数是0.1NA |
| D.5.6g Fe与2.24LCl2充分反应转移电子数为0.2NA |
下列有关化学用语表示正确的是
A.苯甲醛: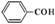 |
B.Mg2+的结构示意图: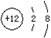 |
C.CO2的电子式: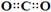 |
D.核内有8个中子的碳原子: C C |