14.重水D2O的离子积为1.6×10-15,可以用PH一样的定义来规定PD= —lgc(D+),以下关于PD的叙述正确的是
| A.中性溶液中PD=7 |
| B.在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中PD=12 |
| C.在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中PD=2 |
| D.在100mL 0.25mol·L-1的NaOD重水溶液中加入50mL 0.2mol·L-1DCl的的重水溶液,其中PD=1 |
13.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH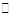 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.升高温度 |
| C.加少量冰醋酸 | D.加水 |
12.有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
| A.物质的量浓度c(甲)=10c(乙) |
| B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 |
| C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲) |
| D.甲中的c(OH-)为乙中c(OH-)的1/10倍 |
11.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是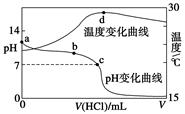
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
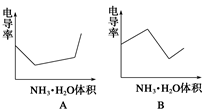
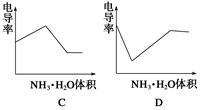
10.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。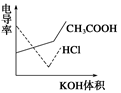
下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是