下列离子方程式书写正确的是
| A.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B.硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-=SO42-+H2O |
| C.Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
| D.向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是
| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA B2-+HA=HB-+A-则下列说法正确的是:
A、H2B的电离方程式为:H2B 2H++ B2-
2H++ B2-
B、结合质子能力由强到弱的顺序为:B2->A->HB-
C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
合成氨反应:N2(g) + 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图: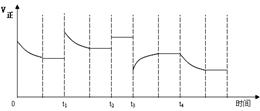
下列说法正确的是
| A.t1时增大了压强 |
| B.t2时同倍数增加N2、H2的物质的量 |
| C.t3时降低了温度 |
| D.t4时增大了c(NH3) |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3 - 3e-+ H2O=FeO42-+5H+ |
用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
| A.5~9 | B.4.0~10.0 | C.4.3~9.7 | D.以上都不正确 |