某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
| ③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为 。
(2)上述实验说明黑色粉末X中含有 。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是 。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为 。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)= mol/L。
Ⅰ、高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见图)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。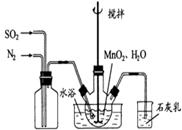
①石灰乳作用:。
②若实验中将 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH="7.7," 请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①;
②;
③检验SO42-是否被洗涤除去;④用少量乙醇洗涤;⑤低于100℃干燥。
Ⅱ、锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
(1)判断步骤②滴定终点的方法是。
(2)计算合金中Cu的质量分数。
(10分)(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
①检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:
___________________________________________________________________
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是________。
Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图)。实验过程中需要使用的仪器有。(选填下列仪器对应的字母)
由下图可知NaOH溶液的物质的量浓度为。(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了。对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计。
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关。
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 |
设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 |
① |
| 2.在加热后的溶液中滴加酚酞,并在上方滴一些植物油 |
②利用植物油隔绝 |
(3)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
| 实验方法 |
观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 |
浓度大的溶液中酚酞红色会消失,则证明红色消失与氢氧化钠溶液的浓度大小有关 |
| 方案二:向原红色消失的溶液中加① (填试剂名称) |
② |
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)实验时,B中发生反应的化学方程式为
,。
(2)装置C、D中盛放的试剂分别为:
C,D(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是,它在该实验中的主要作用是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将(填“偏高”、
“偏低”或“无影响”)。
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为:(结果用分数表示,可不化简)。
实验室需用固体烧碱配制480 mL 0.32mol·L—1的NaOH溶液。
①需称量g的烧碱固体,固体应放在中置于天平右盘称量。
②配制过程中,不需要使用的仪器是(填符号)。
A.烧杯 B.量筒 C.玻璃棒
D.500mL容量瓶 E.漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是(填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是:偏高的是:
A.称量时药品和砝码位置颠倒
B.称量时间过长
C.溶液未冷却即转入容量瓶
D.容量瓶洗净后未烘干
E.定容时俯视刻度线
F.定容后倒转摇匀,发现液面低于刻度线而未加水补充