是氧化还原反应,但水既不是氧化剂又不是还原剂的是( )
| A.SO3 + H2O=H2SO4 | B.Cl2+ H2O = HCl + HClO |
| C.2F2 + 2H2O="4HF" + O2 | D.2Na + 2H2O="2NaOH" + H2 |
在溶液中加入足量的Na2O2后仍能大量共存的离子组是
| A.NH4+、Ba2+、Cl—、NO3— | B.K+、AlO2—、Cl—、SO42— |
| C.Ca2+、Mg2+、NO3—、HCO3— | D.Na+、Cl—、CO32—、SO32— |
已知: , ,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
| A. |
|
B. |
|
| C. |
|
D. |
|
下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
| A. | 3和17 | B. | 1和8 | C. | 1和6 | D. | 7和12 |
为实现“绿色奥运”,下列环保建议中你认为可以采纳的是
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
| A.①③④ | B.②③④⑤ | C.①②④⑤ | D.全部 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
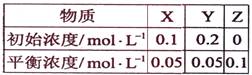
 下列说法错误的是:()
下列说法错误的是:()



| A. | 反应达到平衡时,X的转化率为50%  |
B. | 反应可表示为X+3Y  2Z,其平衡常数为1600 2Z,其平衡常数为1600  |
C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大  |
D. | 改变温度可以改变此反应的平衡常数 |