下列离子方程式 错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2: 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| C.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合: NH4++Al3++SO42-+Ba2++4OH-= BaSO4↓+Al (OH)3↓+NH3·H2O |
| D.铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
N2+3H2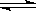 2NH3合成氨反应中,在下列情况下,不能使反应速率加快的是
2NH3合成氨反应中,在下列情况下,不能使反应速率加快的是
| A.充入氮气 | B.减小压强,扩大容器体积 |
| C.加入催化剂 | D.适当升高温度 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe +2H2O+O2 =2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-= Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-= 4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
| A.正极附近的SO42-离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
| A.CH3OH(l)+ 3/2O2(g)=CO2(g)+ 2H2O(l);△H="+725.8" kJ·mol-1 |
| B.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="-1452" kJ·mol-1 |
| C.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="-725.8" kJ·mol-1 |
| D.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="+1452" kJ·mol-1 |
下列说法或表示法错误的是
| A.吸热反应是由于反应物的总能量比生成物的总能量低 |
| B.放热反应的△H<0 |
| C.需要加热才能发生反应一定是吸热反应 |
| D.酸碱中和反应都是放热反应 |