25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42- |
| B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3- |
| C.使石蕊试液变红色的溶液中:Fe2+、K+、NO3-、SO42- |
| D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
下列化学性质中,烷烃具有的是()
| A.可发生加成反应 | B.能使溴水褪色 |
| C.与氯气发生取代反应 | D.能使高锰酸钾溶液褪色 |
.M和N两溶液分别含有下列十二种离子中的五种和七种离子: K+、Na+、H+、NH4+、 Fe3+、Al3+、Cl-、OH-、NO3-、S2-、CO32-、SO42-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是 ( )
| A.OH-、CO32-、SO42- | B.S2-、Cl-、SO42- |
| C.CO32-、NO3-、S2- | D.Cl-、SO42-、NO3- |
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A. |
B.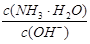 |
| C.c(H+)和c(OH-)的乘积 | D.OH-的物质的量 |
25℃时,amol/L稀盐酸与bmoL/L稀氢氧化钠溶液等体积混合后,所得溶液的pH=12(混合液的总体积可视为原两种溶液体积相加),则a和b的关系为()。
| A.a=b/2 | B.b=a+0.02 | C.a=b+0.02 | D. a=b+0.01 |
在pH = 3的FeCl3溶液和pH = 3的盐酸中,由水电离出来的H+的浓度分别为C1、C2,pH = 11的Na2CO3溶液中水电离出来的OH 的浓度为C3 , 则它们之间的关系是
的浓度为C3 , 则它们之间的关系是
| A.C1<C2<C3 | B.C1=C3>C2 | C.C1>C2>C3 | D.无法判断 |