已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合上右图。则甲和X(要求甲和X能互换)不可能是 [提示:Al3++3AlO2-+6H2O=4Al(OH)3]( )
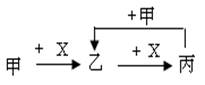
| A.C和O2 | B.SO2 和NaOH溶液 |
| C.Cl2和Fe | D.AlCl3溶液和NaOH溶液 |
化学与环境、材料、信息、能关系密切,下列说法正确的是
| A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B.绿色化学的核心是利用化学原理治理环境污染 |
| C.将煤气化或液化,获得清洁燃料 |
| D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
下列图示与对应的叙述相符的是 ()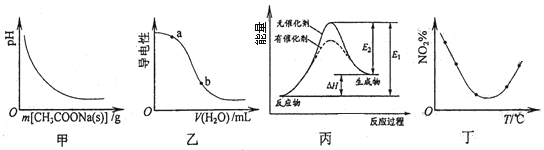
| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| 甲 |
乙 |
丙 |
丁 |
||
| 起始物质的量 |
n(SO2)/mol |
0.40 |
0 |
0.80 |
0.02 |
| n(O2)/mol |
0.24 |
0 |
0.48 |
0.04 |
|
| n(SO3)/mol |
0 |
0.40 |
0 |
0.40 |
|
| 含硫反应物的平衡转化率% |
80 |
 1 1 |
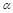 2 2 |
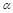 3 3 |
下列判断中,正确的是
A.乙中SO3的平衡转化率为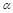 1=20%
1=20%
B.平衡时,丙中c(SO3)是甲中的2倍
C.平衡时,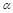 3<
3<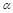 1
1
D.该温度下,平衡常数的值为400
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg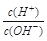 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
| A.A点时加入氢氧化钠溶液体积为20 mL |
| B.室温时0.01 mol·L-1的醋酸溶液pH=4 |
| C.OA段溶液中:c(CH3COO-)> c(CH3COOH) |
| D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+) |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
用铂丝蘸取少量某无色溶液进行焰色反应 |
火焰呈黄色 |
该溶液一定是钠盐溶液 |
| B |
向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 |
出现黄色沉淀 |
Ksp(AgCl)>Ksp(AgI) |
| C |
向溶液X中滴加稀盐酸 |
有气体产生 |
溶液X 中一定含有CO32- |
| D |
向含H2SO4的淀粉水解液中加入新制的Cu(OH)2,煮沸 |
没有砖红色沉淀 |
淀粉未水解 |