下列描述中正确的是
| A.强酸与强碱反应都是放热反应 |
| B.氧化还原反应一定都是放热反应 |
| C.放热反应的反应速率总是大于吸热反应的反应速率 |
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同 不同 |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
( )
| A.①②⑥ | B.全部 | C.①③④⑤ | D.②③⑥ |
某温度下,已知反应mX(g)+nY(g) qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
| A.反应速率v正(X)=v逆(Y) | B.降低温度,的值变小 |
| C.增加Y的物质的量,X的转化率减小 | D.加入X,反应的ΔH增大 |
下列叙述中一定能判断某化学平衡发生移动的是
| A.混合物中各组分的浓度改变 | B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 | D.混合体系的压强发生改变 |
在容积一定的密闭容器中,反应2A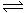 B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是()
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是()
| A.正反应是吸热反应,且A不是气态 | B.正反应是放热反应,且A是气态 |
| C.其他条件不变,加入少量A,该平衡向正方向移 | D.改变压强对该平衡的移动无影响 |
在一定条件下,可逆反应:N2(g)+3H2(g)  2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()
2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()
| A.加催化剂V正、V逆都发生变化且变化的倍数相等 |
| B.加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 |
| C.降温,V正、V逆都减小,且V正减小倍数小于V逆减小倍数 |
| D.加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 |