实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中必须用到的玻璃仪器有: 。
(2)根据计算得知,所需NaOH的质量为 g。
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用50mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动。
C.将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.加水至离刻度线1~2cm处改用胶头滴管加水,使溶液凹面恰好与刻度相切
(4)下列操作对所配浓度有何影响(填写字母)
偏大的有 ;
偏小的有 ;
无影响的有 。
A.称量用了生锈的砝码;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
某实验小组用下列装置进行乙醇催化氧化的实验。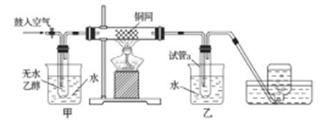
实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
反应进行一段时间后,干燥管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填试验操作名称)即可除去。
为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。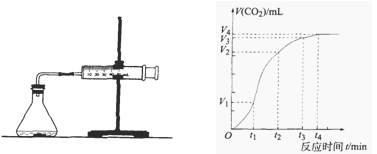
(1)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是,可能的原因是;收集到的气体最多的是时间段。
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有;
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.通入HCl |
(3)在t4后,收集到的气体的体积不再增加,可能的原因是。
(12分)某化学学习小组采用下图所提供的仪器装置(夹持仪器已略去)设计实验:验证浓硝酸的氧化性。实验表明浓硝酸能将NO氧化成NO2,由此得出的结论是浓硝酸具有氧化性。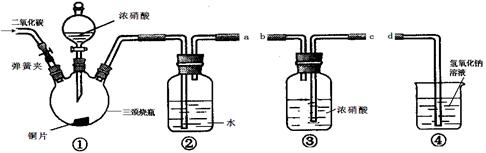
试回答有关问题:
(1)仪器接口的连接顺序为___________ ____________;
(2)按(1)中连接顺序安装好装置后下一步的操作是___ ____;
加入药品后,打开弹簧夹,通入CO2一段时间,通入CO2的目的是___________________________________________________;
关闭弹簧夹,将装置④中的导管末端伸入氢氧化钠溶液中是为了_________________ __________________;
(3)装置②发生反应的化学方程式是___________________________________;
(4)该小组得出的结论所依据的实验现象是_____________________________。
实验室用下列仪器和药品制取干燥纯净的氯气。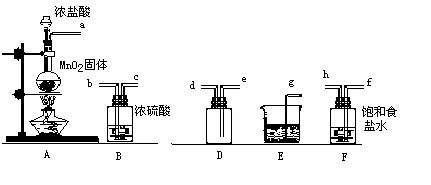
按气流从左到右,装置正确的连接顺序为()接()接()接()接()接()接()接()(填各接口字母)
装置F的作用是,装置E的作用是。
装置A和E中的反应化学方程式为
 :
:某校化学兴趣小组称取8.7g二氧化锰与足量10mol/L的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1 = L
若该小组量取了10mol/L的浓盐酸40ml,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1V2(填“>”、“<”或“=”),原因是
实验室可利用乙醇、铜或铜的化合物制备乙醛,如图是某兴趣小组设计的实验装置,右侧的反应装置相同,而左侧的气体发生装置不同,试管C中装有水(加热装置未画出),试回答:
(1)两套装置中的A、B处都需加热,A处用水浴加热,B处用__________加热,A处用水浴加热的主要优点是__________。
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是__________,B中反应的化学方程式是__________。
(3)若按乙装置进行实验,则B管中应装__________,B中反应的化学方程式是__________。
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液并采用水浴加热可观察到有银镜生成,写出该过程的离子方程式__________ 。
(5)实验完成后,应在C试管中加入__________可洗去银镜。