已知:常温常压下,D、E、F、I、J为气体;E能使澄清石灰水变浑浊,1molE与含1molF的水溶液恰好反应生成B,B是一种常见的化肥。物质A—K之间有如下图所示转化关系(部分反应中生成的水已略去)。
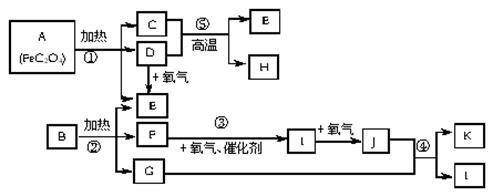
试回答下列问题:
(1) 已知A中[FeC2O4]和C中Fe元素均为+2价,则FeC2O4中C元素的化合价为 ,E的化学式为 。
(2) 写出反应③、④、⑤的化学方程式
③___________
④___________
⑤____________
(3)少量H与K的浓溶液在一定条件下反应若有1molK被还原时,转移的电子总数为 个。
(4) 写出过量单质H与K的稀溶液反应的离子方程式:
、
、
、
、
是五种短周期元素,原子序数依次增大。
、
两元素最高正价与最低负价之和均为0;Q与
同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)。
(2)
与
能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)。
(3)由以上某些元素组成的化合物
、
、
、
有如下转化关系:
 (在水溶液中进行)
(在水溶液中进行)
其中,
是溶于水显酸性的气体;
是淡黄色固体。写出
的结构式:;
的电子式:。
①如果
、
均由三种元素组成,
为两性不溶物,则A的化学式为;由
转化为
的离子方程式为。
②如果
由三种元素组成,
由四种元素组成,
、
溶液均显碱性。用离子方程式表示A溶液显碱性的原因:。
、
浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有。
五种短周期元素
、
、
、
、
的原子序数依次增大,
和
同族,
和
同族,
离子和
离子具有相同的电子层结构。
和
、
、
均能形成共价型化合物。
和
形成的化合物在水中呈碱性,
和
形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是(填元素符号);
(2)由
和
、
、
所形成的共价型化合物中,热稳定性最差的是(用化学式表示);
(3)
和
形成的化合物与
和
形成的化合物反应,产物的化学式为,其中存在的化学键类型为;
(4)
最高价氧化物的水化物的化学式为;
(5)单质
在充足的单质
中燃烧,反应的化学方程式为;
在不充足的
中燃烧,生成的主要产物的化学式为;
(6)单质
与水反应的离子方程式为。
、
、
、
是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信 息 |
|
的最高价氧化物对应的水化物化学式为H2XO3 |
|
|
是地壳中含量最高的元素 |
|
|
的基态原子最外层电子排布式为3s23p1 |
|
|
的一种核素的质量数为28,中子数为14 |
(1)
位于元素周期表第周期第族;
的原子半径比X的(填"大"或"小")。
(2)
的第一电离能比
的(填"大"或"小");
由固态变为气态所需克服的微粒间作用力是;氢元素、
、
的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称。
(3)振荡下,向
单质与盐酸反应后的无色溶液中滴加
溶液直至过量,能观察到的现象是;
的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是。
(4)在25℃、101
下,已知13.5
的
固体单质在
气体中完全燃烧后恢复至原状态,放热419
,该反应的热化学方程式是。
图
所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图
所示。
回答下列问题:
(1)图
对应的物质名称是,其晶胞中的原子数为,晶体类型为。
(2)d中元素的原子核外电子排布式为。
(3)图
中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为。
(4)图
中的双原子分子中,极性最大的分子是。
(5)k的分子式为,中心原子的杂化轨道类型为,属于分子(填"极性"或"非极性")。
肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
已知以下信息:
① ;
;
②
为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)
的化学名称为。
(2)
和
反应生成
的化学方程式为。
(3)
中含有官能团的名称为。
(4)
和
反应生成
的化学方程式为,反应类型为。
(5)
的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为(写结构简式)。