下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

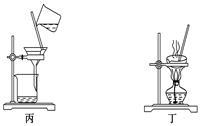
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离氯化锰溶液和二氧化锰 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
右图是实验室制溴苯的装置图,下列说法正确的是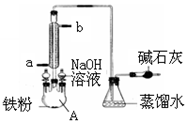
| A.三颈烧瓶中左上侧的分液漏斗中加入的是苯和溴水 |
| B.仪器A的名称叫蒸馏烧瓶 |
| C.锥形瓶中的导管口出现大量白雾 |
| D.碱石灰作用是防止空气中水蒸气进入反应体系 |
下图表示4-溴-1-环己醇所发生的4个不同反应。其中产物只含有一种官能团的反应是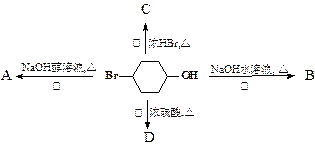
| A.②③ | B.①④ | C.①②④ | D.①②③④ |
有如下合成路线,甲经二步转化为丙:
下列叙述错误的是
| A.甲和丙均可与酸性KMnO4溶液发生反应 |
| B.反应(1)的无机试剂是液溴,铁作催化剂 |
| C.步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲。 |
| D.反应(2)反应属于取代反应 |
有机物A的结构简式如右图。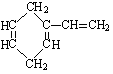
它的同分异构体中属于芳香烃的结构共有
A.3种 |
B.4种 | C.5种 | D.6种 |
某种烃与H21∶1加成后的产物如右图所示:
则该烃的结构式可能有
| 则该烯烃的结构 |
A.2种 B.3种 C.4种D.6种