某无色透明溶液中可能含有以下离子中的若干种K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色
沉淀溶解。根据以上现象判断原溶液中:
| A.②中无色气体中有NO,可能含CO2 |
| B.③中沉淀有BaSO4,可能含BaCO3 |
| C.肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+ 、Cl- |
| D.②中红棕色气体通入水中发生反应的离子方程式为:3NO2 + H2O = H++ NO3- + 2NO |
钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是()
下列说法正确的是()
A.反应①、②中电子转移数目相等 |
B.反应①中氧化剂是氧气和水 |
C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是()




A.锡青铜的熔点比纯铜高 |
B.在自然环境中,锡青铜中的锡对铜起保护作用 |
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 |
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe2++4OH-。 以下说法正确的是()
以下说法正确的是()
A.负极发生的反应为:Fe-2e-Fe2+ |
B.正极发生的反应为:2H2O+O2+2e-4OH- |
C.原电池是将电能转变为化学能的装置 |
D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
氯化铜(CuCl2·2H2O)中含FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
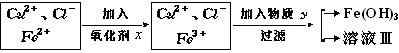
 ↓蒸发结晶
↓蒸发结晶
↓ CuCl2·2H2O(纯)
CuCl2·2H2O(纯) 氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。)()
氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。)()
| A.H2O2、CuO | B.KMnO4、Na2O | C.NaClO、Cu(OH)2 | D.K2Cr2O7、NaOH |
将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为()。
| A.1.5mol/L | B.0.5mol/L |
C.2mol/L | D.1.2mol/L |