 都具有氧化性,其氧化性
都具有氧化性,其氧化性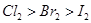 ,
, 能把溴从溴化物中置换出来,其余依次类推。向
能把溴从溴化物中置换出来,其余依次类推。向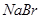 、
、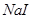 的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
| A.NaCl | B.NaCl NaBr |
| C.NaCl NaBr NaI | D.NaCl NaI |
碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意( )
A.通入足量氧气 B.避免与氧气接触
C.通入少量氯气 D.通入少量氧气
NA表示阿伏加德罗常数,下列说法正确的是 ( )
| A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子 |
| B.1mol Na2O2与足量CO2反应时,转移2NA个电子 |
| C.1mol·L-1的NaOH溶液中含Na+数目为NA |
| D.23gNa+中含有的电子数为NA |
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是 ( )
| A.向NaAlO2溶液中滴入HCl至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的A1C13溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
常温下,装有氮气和氯气混合物的试管倒立于足量的水中,经足够长时间光照,试管气体体积缩小为原来的3/5(假定气体都存在于试管中),则原氮气和氯气的体积比为( )
| A.2:3 | B.3:2 | C.1:4 | D.1:6 |
将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为 ( )
| A.1:1 | B.1:2 | C.3:4 | D.1:8 |