NA表示阿伏加德罗常数,下列说法不正确的是
| A.H2SO4的摩尔质量(kg/mol)与NA个硫酸分子的质量(g)在数值上相等 |
| B.NA个氧气分子和NA个氮气分子的质量比为8∶7 |
| C.1.5 L 0.3 mol·L-1Na2SO4溶液中含0.9NA个Na+ |
| D.非标准状况下,22.4LO2中含有氧分子可能为NA个 |
下列说法正确的是
| A.物质燃烧一定是放热反应 |
| B.断开反应物中的化学键要放出能量 |
| C.放热的化学反应不需要加热都能发生 |
| D.化学反应除了生成新的物质外,还伴随着能量的变化 |
将2molS02和1molO2放入一个密闭容器中,在一定的条件下反应到达“平衡状态”,此时,下列所示容器内存在各物质的物质的量中,一定不可能的是
| A.0mol S02 | B.1mol S02 | C.2mol S03 | D.0.3mol O2 |
下列离子方程式正确的是
| A.Cl2与NaOH溶液反应:Cl2+OH-==Cl-+ClO-+H2O |
| B.向稀氨水中加入稀盐酸: NH3·H2O+H+=NH4++H2O |
| C.铜片加入浓硝酸中: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
| D.Cl2通入KI溶液中:Cl2 + I_= 2Cl- + I |
下表是元素周期表的一部分,有关说法正确的是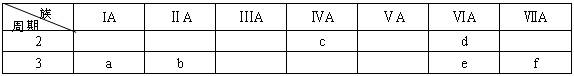
| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.六种元素中,c元素单质的化学性质最活泼 |
| D.e、f的最高价氧化物对应的水化物的酸性依次增强 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒
| A.①③④ | B.①②③ | C.①②④ | D.②③④ |