某待测液中可能含有大量Mg2+、Fe3+、K+、H+、NO3-、SO42-、OH-离子中的一种或几种,现通过下实验进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中滴加NaOH溶液,开始阶段无明显现象,后来有白色沉淀生成,
③向上述待测液溶液中加入BaCl2溶液,无现象。
(1)据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 。
(2)依次写出②中加入氢氧化钠溶液后的离子反应方程式 , 。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知: >
> ,则该反应是热反应。
,则该反应是热反应。
(2)图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡状态的是。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2
D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向反应方向移动(填“正”或“逆”),K值(填“增大”、“减小”或“不变”)
下图是一个化学过程的示意图,回答下列问题:
(1)甲池是装置,电极A的名称是。
(2)甲装置中通入CH4的电极反应式为,乙装置中B(Ag)的电极反应式为,丙装置中D极的产物是(写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入(写化学式)。
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:
①反应的热化学方程式为____________________________________________。
②已知:

则

(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) ="=" NH3(g)ΔH =。
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 |
待测液体积(mL) |
所消耗NaOH标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.54 |
| 2 |
20.00 |
6.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.36 |
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是(填“偏高”或“偏低”或“无影响”,下同)。
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在中(填“甲”或“乙”),该反应的离子方程式为:。
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):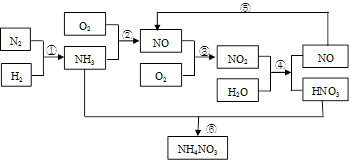
(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3 +___O2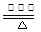 ____NO+ ________
____NO+ ________
(3)化学反应_______(填序号)是非氧化还原反应,离子方程式为_________________
(4)有人设计了一个反应来制备硝酸NO2+NH3 — HNO3+H2O(未配平),你认为该反应(填“能”或“不能”)发生,理由是______________________。