如图是乙醇燃料电池的实验装置图,下列有关说法一定正确的是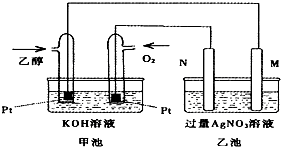
| A.若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 |
| B.甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ |
| C.甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.40g |
| D.M电极上的电极反应式为:Ag++e-=Ag |
反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1,对此反应速率的表示,正确的是()
A.用A表示的反应速率是0.4 mol/L·min
B.分别用B、C、D表示反应的速率其比值是3 :2 :1
C.在2 min末的反应速率,用 B表示是0.3 mol/L·min
D.在这2 min内用 B和C表示的反应速率的值都是逐渐减小的
对于某一可逆反应来说,使用催化剂的作用是()
| A.提高反应物的转化率 |
| B.以同样程度改变正逆反应速率 |
| C.增大正反应速率,减少逆反应速率 |
| D.改变平衡混合物的组成 |
在10L 密闭容器里发生:

 反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 可表示为
可表示为
A. |
B. |
C.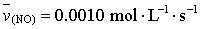 |
D. |
在一定温度下,可逆反应X(气)+3Y(气) 2Z(气)达到平衡的标志是
2Z(气)达到平衡的标志是
| A.Z生成的速率与Z分解的速率相等 |
| B.单位时间生成a mol X,同时生成 3a mol Y |
| C.X、Y、Z的浓度不再变化 |
| D.X、Y、Z的分子数比为1 :3 :2 |
下列方法能增加活化分子百分数的是()
| A.增加某一组分的浓度 | B.增体系的大压强 |
| C.升高体系的温度 | D.使用合适的催化剂 |