将O2、CH4、Na2O2放入密闭容器中,在150℃条件下用电火花引燃,充分反应后,容器中无气体,且将残余物溶于水中无气体放出。则O2、CH4、Na2O2的物质的量之比与反应后容器内固体的成分为
| A.1:2:6 ;Na2CO3和NaHCO3 | B.2:1:4 ;Na2CO3 |
| C.1:2:6; Na2CO3和NaOH | D.2:1:4; Na2CO3和NaOH |
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是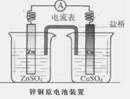
| A.Cu片上发生氧化反应 |
| B.电子由Cu片经外电路流向Zn片 |
| C.盐桥中的Cl―移向ZnSO4溶液 |
| D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
实验室保存下列试剂的方法不正确的是
| A.钠保存在煤油中 |
| B.用棕色试剂瓶盛放新制的氯 |
| C.用带玻璃塞的试剂瓶盛放NaOH溶液 |
| D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
下列环境污染与其产生的原因不相关的是
| A |
B |
C |
D |
|
| 环境污染 |
 白色污染 |
 雾霾 雾霾 |
 臭氧空洞 臭氧空洞 |
 酸雨 酸雨 |
| 产生原因 |
生活污水的排放 |
汽车尾气的排放 |
氟利昂的使用 |
煤的直接燃烧 |
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g) + Z(g)△H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g)△H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
| 反应时间(min) |
0 |
5 |
15 |
17 |
20 |
| X的浓度(mol·L-1) |
1.0 |
0.4 |
0.4 |
0.7 |
0.7 |
A.0~5 min时,该反应的速率为v(X)="0.12" mol·L-1·min-1
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30 %
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B.加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中都有可逆反应发生 |