在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH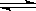 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,反应速率增大,平衡向逆反应方向移动 |
| C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
有关合金的叙述正确的是()
| A.合金的密度比各成分金属小 |
| B.合金的抗腐蚀性能都很好 |
| C.合金的导电性能力比成分金属强 |
| D.多数合金比成分金属熔点低,硬度大 |
根据下列四种金属的熔、沸点,判断其中不能形成合金的是()
| A.铜与钠 | B.铝与钠 | C.钾与钠 | D.铝与铜 |
把ag铁铝粉末溶于足量的盐酸中,加入过量的NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为ag,则原合金中铁的质量分数为()
| A.70% | B.52.4% | C.47.6% | D.30% |
下列具有特殊性能的材料中由两种金属元素形成的是()
| A.半导体材料砷化镓 | B.吸氢材料镧镍合金 |
| C.透明陶瓷材料硒化锌 | D.超导体材料K30C60 |
近年来正在探索用铝粉做燃料的可能性,以期使铝成为一种石油的替代物。假设铝作为一种普通的新能源被开发利用,下列关于其有利因素的说法错误的是()
| A.铝质轻便于运输贮存且安全 |
| B.地球上的铝矿资源丰富 |
| C.铝燃烧时放出的热量大且产物对环境的污染容易得到控制 |
| D.电冶铝的工业技术发达,成本低廉 |