已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8 mol电子转移,此时硝酸的还原产物可能是
| A.N2O | B.NO2 | C.N2O4 | D.NO |
下列推断正确的是
| A.由C(石墨)=C(金刚石)△H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
B.可逆反应2SO2(g)+O2(g)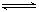 2SO3(g) △H<0,若平衡后再充入一定量氧气,则ΔH增大 2SO3(g) △H<0,若平衡后再充入一定量氧气,则ΔH增大 |
| C.已知CO(g)的燃烧热ΔH=-283.0 kJ·mol-1,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol |
D.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 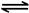 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH—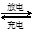 2CO32— + 6H2O。则下列说法不正确的是
2CO32— + 6H2O。则下列说法不正确的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e—+8OH—=CO32— +6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是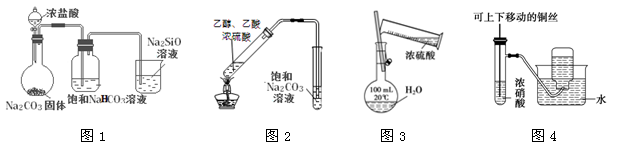
A.用图1所示装置可比较Cl、C、Si的非金属性强弱
B.用图2所示装置可完成实验室制取乙酸乙酯
C.用图3所示装置可配制一定浓度的溶液
D.用图4所示装置可用于制备并收集少量NO2气体
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2 mol,则NaOH的浓度为
| A.2mol/L | B.1.8mol/L | C.2.4 mol/L | D.3.6 mol/L |
下列各组离子在指定环境中一定能大量共存的是
| A.能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、S2- |
| B.存在较多Fe3+的溶液中:Na+、SCN-、CO32-、K+ |
| C.与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3- |
| D.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- |