在3Cu+8HNO 3(稀)= 3Cu(NO3)2+4H2O+2NO↑中, 是还原剂, 是还原产物,若有11.2L(标准状况)NO气体生成,则电子转移的总数是 。写出以上反应的离子方程式 。
一定条件下合成乙烯:
6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H1
CH2=CH2(g)+4H2O(g) △H1
已知:2H2(g)+O2(g)=2 H2O(g)△H2=-480 kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2 H2O(g) △H3=-1400 kJ•mol-1
(1)△H1= 。请标出该反应电子转移的方向和数目 。
(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 。
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM >KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为 (保留两位有效 数字)。
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有 (任写一条)。
(5)电解法可制取乙烯(下图),电极a接电源的 极,该电极反应式为 。
糠醛(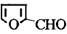 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了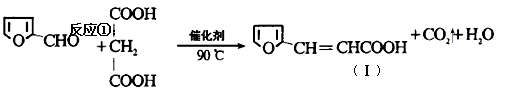
(1)糠醛的分子式为 ,1mol糠醛最多能与 mol H2反应。
(2)关于化合物Ⅰ的说法正确的是 。
| A.核磁共振氢谱中有4组信号峰 | B.能使酸性KMnO4溶液褪色 |
| C.能发生加聚反应和缩聚反应 | D.能发生取代反应和加成反应 |
(3)芳香化合物Ⅱ是化合物Ⅰ的同分异构体,能发生银镜反应,遇FeCl3溶液显紫色,任写一个Ⅱ的结构简式 。
(4)下面是由ClCH2CH2COOH合成丙二酸二乙酯的过程: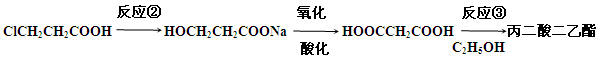
反应②的条件是 ,反应③的化学方程式为 。
(5)水杨醛(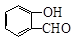 )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 。
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 。
[《物质结构与性质》选考题]现代世界产量最高的金属是Fe、Al、Cu.
(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为 ;Fe2+的电子排布式为 。
(2)Cu(OH)2溶于浓氨水形成 色铜氨溶液;乙二酸( )分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
)分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
(3)以下变化伴随化学键破坏的是 (填下列选项标号)
| A.冰融化 | B.铝气化 | C.AlCl3溶于水 | D.胆矾受热变白 |
(4)二氧化硅晶体结构示意图如下,每个氧原子最近且等距离相邻 个氧原子。
以天然气为原料合成氨是当下主流合成氨方式,其过程简示如下:
(1)甲烷脱硫的主要目的是 。
(2)甲烷一次转化发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)  。在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。
。在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。
(3)传统的化学脱碳法是用热碳酸钾溶液洗气,用什么方法可以使洗气后的碳酸钾溶液再生以循环使用? 。
铜洗能较彻底脱碳脱硫。醋酸亚铜溶于过量氨水形成的铜洗液,可吸收H2S、O2、CO、CO2等,该铜洗液吸收CO2的化学方程式: 。
(4)n(N2):n(H2)="1" : 3原料气进入合成塔,控制反应条件之外采取什么措施提高原料气利用率? 。
(5)NaCl、NaBr、NaI混合溶液中滴入AgNO3溶液至c(Ag+)=0.07 mol·L-1,溶液中浓度比
c(Cl-):c(Br-):c(I-)= : :1。
| AgCl |
AgBr |
AgI |
|
| Ksp |
2×10-10 |
5×10-13 |
1×10-16 |
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金即可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。