实验室配制500mL0.1mol/LNa2CO3溶液。回答下列问题
(1) 用托盘天平应称取十水碳酸钠(Na2CO3·10H2O)晶体的质量为 。
(2) 用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的编号为(同一步骤可用多次): B→( )→( )→( )→B→( )→( )→( )。
A、调整零点
B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量
D、称量空的小烧杯
E、将砝码放回砝码盒内
F、记录称量结果.
(3) 本实验需用的主要仪器有
(4) 若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、定容时俯视刻度线
B、没有将洗涤液转入容量瓶
C、容量瓶内壁附有水珠而未干燥处理
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________mol·L-1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O===Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
| A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |
某酸性工业废水中含有K2Cr2O7。光照下,草酸能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为(填化学式)。
(3)实验①和②的结果表明;
实验①中0~t1时间段反应速率 (Cr3+)=mol/(L·min) (用代数式表示)。
(Cr3+)=mol/(L·min) (用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:;
假设三:;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·2H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
(15分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: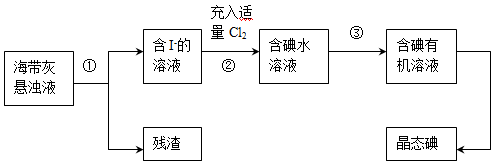
(1)灼烧海带时需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A 烧杯 B 蒸发皿 C.坩埚 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出上图中提取碘的过程中有关的实验操作名称:①,③。
(3)操作③中所用的有机试剂可以是(只填一种),简述选择其理由。
(4)操作过程③可以分解为如下几步:
把盛有溶液的分液漏斗放在铁架台的铁圈中;
把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
检验分液漏斗活塞和上口的玻璃塞是否漏液;
倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
旋开活塞,用烧杯接收溶液;
从分液漏斗上口倒出上层液体;
将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母);
(b)上述G步操作的目的是:;
(c)最后碘的有机溶液是通过获得(填“漏斗上口”或“漏斗下口”)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
(6)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察下图所示实验装置指出其错误之处。
进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A 100mL量筒 B托盘天平 C玻璃棒 D 50mL容量瓶
E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是。
(2)本实验需量取浓硫酸的体积为mL,量取时应选择的仪器是(填上述字母)。
(3)在容量瓶使用方法中,下列操作不正确的是(填字母)。
| A.使用容量瓶前检查它是否漏水 |
| B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| C.将确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
(4)下列情况使所配制的稀硫酸浓度偏大是 (填序号)
①所用的浓硫酸长时间放置在密封不好的容器中
②容量瓶用蒸馏洗涤后残留有少量的水
③定容时俯视溶液的凹液面
某同学用某种粗盐进行提纯实验,步骤见下图.
请回答:
(1) 步骤①和②的操作名称是________.
(2) 步骤③判断加入盐酸“适量”的方法是_____________________________;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含 CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
猜想Ⅰ成立 |
|
| 猜想Ⅱ:固体A中含 BaCO3 |
取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
|
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水,________ |
猜想Ⅲ成立 |