在一密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO3为0.4mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.25mol/L |
下列物质的分类方法恰当的是
| 序号 |
氧化物 |
酸 |
碱 |
盐 |
| A |
熟石灰 |
氯酸钾 |
生石灰 |
蓝矾 |
| B |
生石灰 |
次氯酸 |
纯碱 |
苏打 |
| C |
过氧化氢 |
盐酸 |
碱式碳酸酮 |
氯化铁 |
| D |
氧化钠 |
硫酸 |
烧碱 |
纯碱 |
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是
| A.该反应中旧键断裂需要吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |
下列化学用语正确的是
A.甲醛的电子式: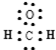 |
B.异丙基的结构式: |
| C.甲醇的化学式:CH4O |
| D.乙醛的结构简式:CH3COH |
如果你家里的食用花生油不慎混入了大量的水,利用你所学的知识,采用最简便的分离方法是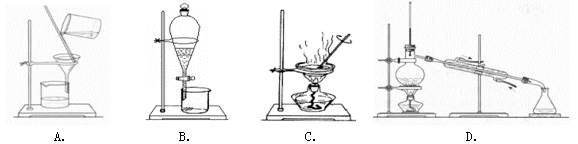
将浓度为0.2mol/LNH4Cl溶液加水不断稀释,下列各量增大的是
| A.c(H+) | B.Kh(NH4Cl)(水解常数) |
| C.c(OH— | D.c(NH4+) |