某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质溶液为FeSO4溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
下列叙述中,正确的是
| A.硫酸的摩尔质量是98g |
| B.1mol氧的质量等于16g |
| C.摩尔是一个基本物理量 |
| D.12g 12C所含原子数称为阿伏加德罗常数 |
将下列物质按酸、碱、盐分类排列,正确的是
| A.硝酸、纯碱、石膏 | B.硫酸、烧碱、小苏打 |
| C.盐酸、乙醇、氯化钠 | D.醋酸、食盐、石灰石 |
下列状态的物质,既属于电解质又能导电的是
| A.酒精 | B.氯化钾晶体 | C.液氯 | D.熔融的氢氧化钠 |
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+
2H2O,负极反应为H2+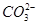 -2e-
-2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O O2↑+2H2O |
B.放电时,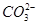 向负极移动 向负极移动 |
| C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
D.放电时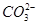 向正极移动 向正极移动 |
以铁(足够)为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后溶液中只有一种沉淀为2 mol Fe(OH)3,则消耗水的物质的量共为
| A.2 mol | B.3 mol | C.4 mol | D.5 mol |