下列各组反应,均可用同一离子方程式表示的是
| A.HCl和Na2CO3溶液反应, HCl溶液和CaCO3反应 |
| B.足量稀H2SO4和Na2CO3溶液反应,足量稀HNO3和K2CO3溶液反应 |
| C.稀H2SO4和Ba(OH)2溶液反应,稀H2SO4和KOH溶液反应 |
| D.BaCO3和稀 H2SO4溶液反应, BaCO3和稀HCl 溶液反应 |
下列化学用语正确的是
A.硫的原子结构示意图: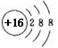 |
B.NH4Cl的电子式: 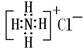 |
C.原子核内有8个中子的氧原子:  |
D.Be2+离子中的质子数和电子数之比为2:1 |
室温时,柠檬水溶液的pH是3,其中的c(OH-)是
| A.0.1 mol/L | B.1×10-3 mol/L |
| C.1×10-7 mol/L | D.1×10-11 mol/L |
下列叙述正确的是
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用75%的乙醇溶液进行消毒
③棉花、蚕丝、人造羊毛的主要成分都是纤维素
④加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白酶,为了提高它的活性,洗衣服时温度越高效果越好
⑤碳酸钠、氢氧化钠、碳酸钙、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥明矾净水利用了胶体的性质
⑦氢氟酸储存在玻璃瓶中
⑧可以用二氧化硅和水反应制备硅酸胶体
| A.①②③⑦ | B.①②⑥ | C.①③④⑧ | D.全都正确 |
下列说法不正确的是
| A.08年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的知识 |
| B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.中国第1艘LNG船“大鹏昊”已于09年5月2日满载65000吨LNG,抵达广东。船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2+ + 2S2O32-+ O2 + aOH-== Y+S4O62-+2H2O,下列说法中,不正确的是
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子总数为4 mol w.^ |