(1)下列几种物质:①H2O、②Fe(OH)3胶体、③Mg、④蔗糖、⑤盐酸溶液、⑥Ca(OH)2、属于电解质的是 ,属于分散系的是 ;(用数字序号填空)
(2)含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
(3)已知: 2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-,Cl2+2Br-===2Cl-+Br2。 向含有1 mol FeI2和1mol FeBr2的溶液中通入2 mol Cl2,充分反应后,此时被氧化的离子是________;(填写离子符号),如果向上述原溶液中通入3 mol Cl2,充分反应后,此时所得溶液中含有的离子 。(填写离子符号,忽略水的电离)
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: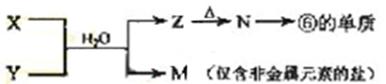
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是;
(2)Q的具有相同化合价且可以相互转变的氧化物是;
(3)R和Y形成的二元化合 物中,R呈现最高化合价的化合物的化学式是;
物中,R呈现最高化合价的化合物的化学式是;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一 种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是。
种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是。
氮是地球上 极为丰富的元素。
极为丰富的元素。
(1)N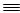 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
(2)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作__________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
(3)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是_____________,与同一个N3-相连的X+有__________个 (白圆圈代表N3-离子)
(白圆圈代表N3-离子)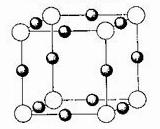
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是。C60和金刚石都是碳的同素异形体,金刚石熔点高于C60熔点,原因是
。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
写出B原子的电子排布式:。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、络合物Fe(CO)5等。
①已知COCl2分子的结构式为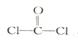 ,则 COCl2分子内含_______(填标号)。
,则 COCl2分子内含_______(填标号)。
A.4个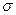 键
键
B.2个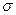 键、2个
键、2个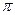 键
键
C.2个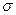 键、1个
键、1个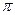 键
键
D.3个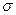 键、1个
键、1个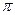 键
键
②Fe(CO )5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学
)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学 键只有配位键,形成的化学键是。
键只有配位键,形成的化学键是。
化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)Y的价电子轨道表示式为;
(2)YX2的电子式是,分子构型为,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
(5)元素X与Y的电负性的大小关系是___________(用元素符号填写,并填﹥、﹤、﹦),
X与Z的第一电离能的大小关系是___________。(用元素符号填写,并填﹥、﹤、﹦)