已知在298K时下述反应的有关数据:
C(s)+ O2(g)═CO(g)△H1=﹣110.5kJ•mol﹣1
O2(g)═CO(g)△H1=﹣110.5kJ•mol﹣1
C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ•mol﹣1
则C(s)+CO2(g)═2CO(g) 的△H 为( )
| A.+283.5kJ•mol﹣1 |
| B.+172.5kJ•mol﹣1 |
| C.﹣172.5kJ•mol﹣1 |
| D.﹣504kJ•mol﹣1 |
“酸雨”的形成主要是由于
| A.森林遭乱砍滥伐,破坏了生态平衡 | B.工业上大量燃烧含硫燃料 |
| C.大气中二氧化碳的含量增多 | D.汽车排出大量尾气 |
比较下述实验方案,判断能够确定一种溶液中一定含有SO42-的事实是
| A.取少量试样溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀生成。 |
| B.取试样溶液,加入BaCl2溶液,有白色沉淀,再加稀HNO3,沉淀不溶解 |
| C.取少量试样的溶液,加入Ba(NO3)2溶液,有白色沉淀生成 |
| D.取少量试样溶液,加入足量盐酸,无沉淀,加入BaCl2溶液,有白色沉淀生成 |
含8.0 g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9 g,则该无水物中一定含有的物质是
| A.Na2S | B.NaHS | C.Na2S和NaHS | D.NaOH和NaHS |
下列实验过程中产生的现象与对应的图形相符的是
A NaHSO3粉末加入HNO3溶液中 B H2S气体通入氯水中
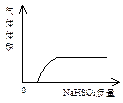
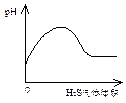
C NaOH溶液滴入Ba(HCO3)2 D CO2气体通入澄清石灰水中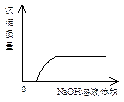
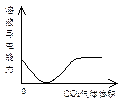
若向含少量水蒸气的容器中通入SO2与H2S共1.00 mol,且知H2S过量,充分反应后,所得的氧化产物比还原产物多8.0 g,则通入的SO2和H2S的物质的量之比可能是
| A.1∶1 | B.1∶2 | C.2∶1 | D.1∶3 |