有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素。已知:①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的电子层数:B=C=2A;④B元素的最高正价与最低负价的绝对值之差为2;⑤F为地壳中含量第二的金属元素。下列说法正确的是
A.B的氧化物对应水化物为强酸
B.F单质与C单质反应的产物只有一种
C.因为E单质的相对分子质量小于溴单质的相对分子质量,所以E单质的熔点比溴单质要低
D.A、D形成的化合物的水溶液呈碱性
已知下述三个实验均能发生化学反应,下列判断正确的是:
①将铁钉放入硫酸铜溶液中
②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
| A.实验①中铁钉做氧化剂 | B.实验②中Fe2+具有还原性 |
| C.实验③中发生的是置换反应 | D.上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
在1 L 1 mol·L-1的氨水中,下列说法正确的是
| A.含有1 mol NH3分子 | B.含NH3和NH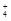 之和为1 mol 之和为1 mol |
| C.含NH3·H2O 1 mol | D.含NH3、NH3·H2O、NH4+之和为1 mol |
下列有关Na2CO3与NaHCO3的说法中正确的是
| A.在水中的溶解性:Na2CO3<NaHCO3 | B.两者都能与酸反应生成CO2 |
| C.热稳定性:Na2CO3<NaHCO3 | D.两者在相同情况下不能相互转化 |
下列物质中能使干燥的有色布条褪色的是
| A.氯水 | B.液氯 | C.氯气 | D.次氯酸 |
我国城市环境中的大气污染物主要是
| A.CO、Cl2、N2、酸雨 | B.HCl、O2、N2、粉尘 |
| C.SO2、NO2、CO、粉尘 | D.NH3、CO2、NO、雾 |