被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2 + 2C + 2Cl2═ TiCl4 + 2CO
(1)用双线桥法标出上述化学方程式的电子转移情况;
(2)指出该反应的氧化剂 ,氧化产物 ;
(3)当消耗标准状况下Cl2 11.2L时,则转移的电子数为 。
.(10分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为;
②计算在80℃时该反应的平衡常数K=;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”);
④要增大该反应的K值,可采取的措施有(填序号)。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)0.60 mol(填“> ”、“<”或“=”)。
(14分)化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: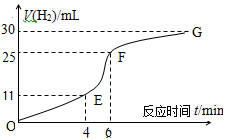
(1)实验过程如图所示,分析判断段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是,一定时间后反应速率逐渐减慢,其原因是。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 E.降低温度 |
II、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: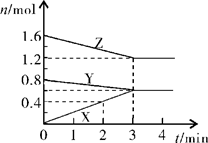
(1)该反应的化学方程式:;
(2)反应开始至2min末,X的反应速率为(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是。
.(14分)已知:①A 是一种分子量为28的气态烃;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。
2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。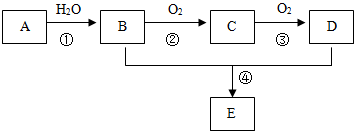
回答下列问题
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①;④。
(4)写出下列反应的化学方程式:②;
④。
(12分)下表列出了A~R 9种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
E |
F |
||||||
| 三 |
A |
C |
D |
G |
R |
|||
| 四 |
B |
H |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的非金属元素是(用元素符号填空)。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是(用化学式填空)。
(4)写出D与氢氧化钠溶液反应的化学方程式: 。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3 倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
⑴W元素原子的L层电子排布式为,W3分子的空间构型为;
⑵化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔
点较高的原因是;
⑶将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中O—C—O的键角约为;
⑷X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z=。