如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置。装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol·L-1。
不同时间电子天平的读数如下表所示:

| 实验操作 |
t/min |
电子天平的读数/g |
| 装置+硫酸溶液 |
|
320.0 |
| 装置+硫酸溶液+样品 |
0 |
335.0 |
| 1 |
334.5 |
|
| 2 |
334.1 |
|
| 3 |
333.8 |
|
| 4 |
333.8 |
(1)反应中生成气体的质量为 。
(2)试计算样品中铝的质量分数?(写出计算过程)
(3)求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度? (写出计算过程)
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuC03和Cu(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为;在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:①过滤②洗涤③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明生成物中只有碳酸铜。
①各装置连接顺序为(用装置编号表示)
②装置C中装有试剂的名称是。
③能证明生成物中只有CuCO3的实验现象是。
(3)若Cu(OH)2和CuCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
①实验结束时通入过量的空气的作用是
②实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成的水的质量,W4:反应后生成二氧化碳的质量,为了测定其组成,至少需要其中个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2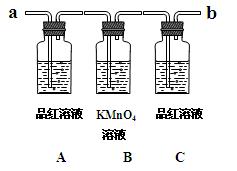
①实验时,反应产生的气体应从端通入;从端连接盛有澄清石灰水的实验装置(用 “a”或“b” 填空)。
②可观察到A瓶的溶液的现象。
③B瓶溶液的作用是。
④C瓶溶液的作用是。
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.40mL |
18.50mL |
| 第二次 |
1.30mL |
18.05mL |
| 第三次 |
3.10mL |
21.20mL |
(1)达到滴定终点的时溶液颜色的变化为 色到色;
色到色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为;
(3)以下操作造成测定结果偏高的原因可能是。
| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.未用标准液润洗碱式滴定管 |
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl—和Br—的还原性强弱。
①选择合理的装置连接:→→。(填字母编号)
②从下列提供的试剂选择你所需的试剂:。(填字母编号)
a. 固体氯化钠 b. 固体二氧化锰c. 浓硫酸
d. 浓盐酸 e. 稀盐酸 f.溴化钠溶液
③实验现象及结论:。
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验,其操作步骤为
①先关闭止水夹,再打开止水夹,使NO2充满试管乙。接着关闭止水夹,打开止水夹 ,最后微热试管乙,使烧杯中的水倒流进入试管乙。
,最后微热试管乙,使烧杯中的水倒流进入试管乙。
②试管乙中的NO2与 水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是(气体按标准状况计算)。
水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是(气体按标准状况计算)。
某同学设计了以下流程来检验碳酸钠粉末中含有少量氯化钠和氢氧化钠。
(1)步骤3的操作名称是;步骤1所需玻璃仪器是;
(2)试剂A是,加入试剂A 的目的是;(填字母编号)
a.检验OH- 离子 b. 检验Cl-离子
c.除去CO32-离子 d.避免对Cl-或OH-的检验的干扰
判断试剂A是否足量的方法是。
(3)步骤4是为了检验离子,所需要的试剂B是。
(4)请简述步骤5的具体操作过程(所加试剂、现象及结论)