填空题
I.如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。

请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
①( )两种物质都是钠的化合物
②( )两种物质都是氧化物
③( )两种物质都是盐
④用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
物质M的化学式为________,写出相应的化学方程式: 。
⑤丁达尔效应是区分胶体与溶液的一种最常用的方法。
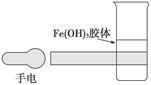
如图是在实验室中进行氢氧化铁胶体丁达尔效应实验的示意图,该图中有一处明显错误是____________________,原因是_________________(试从分散系的分类进行讨论说明)。
II.某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的化学方程式:_____________,______________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)。
①用蒸馏水完全溶解CaCl2后,加入______________________;
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-;
加入_________________,使沉淀完全溶解;
③_________________,得到纯净的硝酸钙晶体。
洪灾过后,饮用水的 消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂
消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
已知硫酸在水中的电离方程式是:H2SO4═ H++ HSO 4—; HSO4—
4—; HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题:
(1)Na2SO4溶液显(填“酸性”,“中性”或“碱性”)。理由是(用离子 方程式表示)。
方程式表示)。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有。
A.c  (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO42—)="0.029" mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO42—)0.029 mol·L-1(填“<”,“>”或“=”),理由是。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是:
。
(5)如果25 ℃时,0.10 mol·L-1H2SO4溶液的pH="-lg" 0.11, 则25 ℃时,0.10 mol·L-1的H2SO4溶液中c(SO42—)=。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下图(部分产物已略去):
(1)工业电解M溶液的化学方程式为。
(2)若A是X、Y同周期的一种常见金属,写出A与B溶液反应的化学方程式是。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为,写出E与F反应的离子方程式是。
(4)B的电子式为:_______ ___,其中的化学键类型为:______________。
___,其中的化学键类型为:______________。
(5)说明M物质的一种用途:_________________。
373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应: 2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
(1)前 20 s内NH3(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率(填“增大”或“减小”,下同)。NH3的平衡浓度。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
d.再充入N2
水是自然界中普遍存在的一种物质,根据下列信息回答问题: (1)
(1) 氧原子基态时价层电子的电子排布图为________________。
氧原子基态时价层电子的电子排布图为________________。
(2)已知2H2O = H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为_________。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由。
稳定性: 理由:
理由: 。
。
沸点:理由:。