下列离子方程式书写正确的是
| A.稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B.NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C.FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D.AICl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是
| A.加热时有无气体放出 |
| B.滴加盐酸时有无气泡放出 |
| C.溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成 |
| D.溶于水后,滴加澄清石灰水,有无白色沉淀生成 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ca2+ |
将铁片分别放入下列物质的溶液中,充分反应后,溶液质量比反应前减轻的是
| A.FeSO4 | B.Fe2(SO4)3 | C.HCl | D.CuSO4 |
下列装置能达到实验目的的是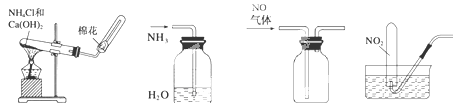
| A.制取氨气 | B.吸收多余氨气 | C.收集NO | D.收集NO2 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.28gCO和N2混合气体中含有原子总数为2NA |
| B.在1L1mol.L-1的氨水中含有NA个NH3分子 |
| C.标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA |
| D.1mol Fe分别与足量Cl2 、S反应,Fe失去电子数都为2NA |