A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质,已知:甲十乙=丁十辛,甲十丙=戊+辛;常温 0.1mol/L丁溶液的pH为13,则下列说法正确的是
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D)>rC)>r(B)
C.1.0L 0.1mol/L戊溶液中含阴离子总的物质的量小于0.lmol
D.1mol甲与足量的乙完全反应共转移约1.204xl024个电子
最近医学界通过用具有放射性的14C试验,发现C80的一种羧酸的衍生物在特定条件下可通过断裂DNA杀死病毒,从而抑制艾滋病(AIDS)的传播。有关14C的叙述中正确的是()
| A.与C80中普通碳原子的化学性质不同 | B.与12C互为同位素 |
| C.与12C的中子数相同 | D.与C80互为同素异形体 |
已知2SO2+O2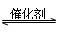 2SO3为放热反应,对该反应的下列说法正确的是( )
2SO3为放热反应,对该反应的下列说法正确的是( )
| A.O2的能量一定高于SO2的能量 |
| B.SO2和O2的总能量一定高于SO3的总能量 |
| C.SO2的能量一定高于SO3的能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
氨水显弱碱性的主要原因是( )
| A.通常状况下,氨的溶解度不大 | B.氨水中的NH3·H2O电离出少量的OH- |
| C.溶于水的氨分子只有少量电离 | D.氨本身的碱性弱 |
有100mLMgCl2和AlCl3的混合溶液,其中c (Mg2+)为0.1mol/L,c (Cl-)为0.65mol/L,要使Mg2+转化为沉淀分离出来,至少需加1mol/L NaOH溶液体积是()
| A.40mL | B.60mL | C.80mL | D.120 mL |
对于体积相同的①(NH4) 2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是()
| A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
C.溶液的pH相同时,由水电离出的 大小顺序是③>②>① 大小顺序是③>②>① |
| D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |