利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
浓盐酸] |
MnO2 |
NaOH[来Com] |
制氯气并吸收尾气[来 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
下列指定微粒的个数比为2∶1的是()
| A.Be2+离子中的质子和电子 |
B.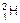 原子中的中子和质子 原子中的中子和质子 |
| C.NaHCO3晶体中的阳离子和阴离子 |
| D.CO气体中分子和原子 |
选择萃取剂将碘水中的 碘萃取出来,这种萃取剂应具备的性质是()
碘萃取出来,这种萃取剂应具备的性质是()
| A.不溶于水,且必须易与碘发生化学反应 | B.不溶于水,且比水更易溶解碘 |
| C.不溶于水,且必须比水密度大 | D.不溶于水,且必须比水密度小 |
下列产品的使用不会对环境造成污染的是( )
| A.含磷洗衣粉 | B.酒精 | C.氟里昂 | D.含汞电池 |
在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是
| A.AB | B.A2B3 | C.AB2 | D.AB3 |
下列科学家中,为我国化学工业作出重大贡献的是 ( )
( )
| A.邓稼先 | B.李四光 | C.华罗庚 | D.侯德榜 |