常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++ H2O2 +2H+ =2Fe3++ 2H2O ;2Fe3++ H2O2=2Fe2++ O2↑+2H+,下列说法中,不正确的是
| A.在H2O2分解过程中,Fe2+是反应的催化剂 |
| B.在H2O2生产过程中,要严格避免混入 Fe2+ |
| C.H2O2的氧化性比Fe3+强,还原性比Fe2+强 |
| D.在H2O2分解过程中,溶液的pH逐渐下降 |
可以判断油脂皂化反应基本完成的现象是
| A.反应液使红色石蕊试纸变蓝色 | B.反应液使蓝色石蕊试纸变红色 |
| C.反应后,静置,反应液分为两层 | D.反应后,静置,反应液不分层 |
下列各组液体混合物,可用分液漏斗分离的是
| A.甘油和乙醇 | B.乙酸乙酯和乙醇 | C.苯酚和丙醇 | D.乙酸乙酯和水 |
用一种试剂可以区别乙醇、乙醛和乙酸,该试剂是
| A.新制Cu(OH)2悬浊液 | B.NaOH溶液 | C.氨水 | D.FeCl3溶液 |
既可以和强酸反应又可以和强碱反应的有机物是
| A.乙醇 | B.乙酸 | C.乙酸乙酯 | D.甘氨酸 |
1 mol A(分子式C6H10O4)经水解后得到1 mol有机物B和2mol有机物C,C经分子内脱水得D,D可发生加聚反应生成高聚物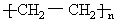 .由此推知A的结构简式为
.由此推知A的结构简式为
| A.HCOOCCH2CH2COOCH2CH3 | B.HOOC(CH2)3COOCH3 |
| C.CH3OOC(CH2)2COOCH3 | D.CH3CH2OOCCOOCH2CH3 |