有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤CO2⑥KNO3溶液⑦氯气,填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;
蛋白质是生物体内的生命物质,是生命现象的体现者,是原生质的重要组成成分。蛋白质相对分子质量巨大,如甲壳动物的白蓝蛋白的相对分子质量越过了6 000 000。蛋白质的结构也非常复杂,种类千变万化,不计其数。
(1)蛋白质分子中含有______、______、______、______四种元素,常含有________元
素。
(2)蛋白质基本组成单位是氨基酸,其通式为__________________________。
(3)氨基酸分子的特点是_________________________________________
(4)氨基酸如何形成蛋白质分子?
(1)从鸡蛋白的溶液中提取蛋白质的方法有______和_______________。
(2)鸡蛋腐败时,常闻到刺激性气味,该气体主要是______,说明蛋白质中含有______元素。
(3)误食重金属盐会中毒,这是因为______________________________________。
(4)浓HNO3溅在皮肤上,使皮肤呈现________色,这是由于浓HNO3和蛋白质发生了________反应的缘故。
(5)鉴定一种织物的成分是真丝还是人造丝,可各取一小块进行________,这是因为_____________________________________________________。
碘缺乏症遍及全球,多发于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有100万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患( )
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾,反应的化学方程式为__________________,氧化产物与还原产物的物质的量之比为__________,能观察到的明显现象是___________________________________________________________。
(4)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应的化学方程式为:KI+3H2O KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
(5)在某温度下,若以12 A的电流强度电解KI溶液10min,理论上可得标况下氢气________L。
维生素C是一种水溶性维生素,其水溶液呈酸性。它的分子式是C6H8O6,人体缺乏这种维生素,易得坏血症,所以维生素C又称抗坏血酸。维生素C的结构简式为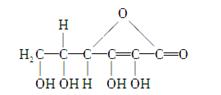
在新鲜的水果、蔬菜、乳制品中都富含维生素C。如新鲜橙汁中维生素C的含量在500 mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量。下面是测定实验分析报告。请填写下列空白:
(1)测定目的:测定××牌软包装橙汁中维生素C的含量。
(2)测定原理:C6H8O6+I2―→C6H6O6+2H++2I-。
(3)实验用品及试剂:
①仪器和用品(自选,略)。
②试剂:指示剂________(填名称),浓度为7.50×10-3mol/L 标准碘溶液、蒸馏水等。
(4)实验过程:取20.00 mL待测橙汁,滴入2滴指示剂。向其中逐滴加入标准碘溶液,消耗碘溶液15.00 mL时,溶液恰好变蓝色。则此橙汁中维生素C的含量是________ mg/L。
从分析数据看,此软包装橙汁是否是纯天然橙汁?______。
A.是 B.可能是 C.不是
制造商可能采取的做法是________。
A.加水稀释天然橙汁B.橙汁已被浓缩C.将维生素C作为添加剂
(5)请你站在国家质检执法人员的角度对××牌软包装橙汁做出处理意见________。
A.继续生产B.停产整顿C.调查后再做结论
(6)有关维生素C说法正确的是( )
①蔬菜应当先洗后切 ②蔬菜应温火慢煮 ③可以发生酯化反应 ④可使溴水褪色 ⑤不能使高锰酸钾酸性溶液褪色
A.①②③④⑤ B.①③④ C.②③⑤ D.①②③④
经研究发现,长期使用我国发明的铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是_____________________________________________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是________________。