实验中的下列操作正确的是
| A.取用试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B.把NaOH固体放在托盘天平左盘的滤纸上称量 |
| C.用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
下列说法正确的是
A.有H、D、T与16O、17O、18O构成的过氧化氢分子的相对分子质量有36个
B.H2、D2、T2互为同素异形体
C.H2、D2、T2在相同条件下的密度比为1:2:3
D.氕、氘发生聚变成其他元素,属于化学变化
设NA代表阿伏加德罗数的数值,下列说法中正确的是
| A.1L1mol/L的K2Cr2O7溶液中 |
| B.1molC60F60分子中碳原子之间共用电子对数为90 NA |
| C.电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64g |
| D.标准状况下,2.24LCl2完全溶于水转移电子数为0.1 NA |
下列说法正确的是
| A.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| B.水银洒落在桌面上可用硫粉覆盖处理 |
| C.离子形成1摩离子晶体释放的能量叫该离子晶体的晶格能 |
| D.风化、钝化、皂化、焰色反应都是化学变化 |
下列有关化学用语使用正确的是
| A.乙烯的结构简式为:CH2CH2 |
B.NH4C1的电子式: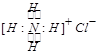 |
| C.Cr原子 的基态简化电子排布式为[Ar]3d54s1 |
D.S原子的外围电子排布图为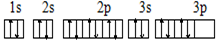 |
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
| A.从海水中提取物质都必须通过化学反应才能实现。 |
| B.“天宫一号”使用的碳纤维是一种新型有机高分子材料 |
| C.将苦卤浓缩、氧化、鼓入热空气或水蒸气提取海水中的溴 |
| D.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸 |