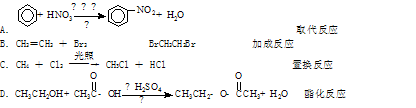现要配制0.01 mol/L的KMnO4溶液,下列操作导致所配溶液浓度偏高的是
| A.称量时,使用了游码,但砝码和药品放颠倒了 |
| B.定容时俯视容量瓶刻度线 |
| C.原容量瓶洗净后没有干燥 |
| D.摇匀后见液面下降,再加水至刻度线 |
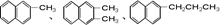 都属于萘(结构简式:
都属于萘(结构简式: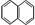 )的同系物。则萘和萘的同系物分子组成通式是()
)的同系物。则萘和萘的同系物分子组成通式是()
| A.CnH2n-6(n≥6) | B.CnH2n-12(n>10) | C.CnH2n-10(n≥10) | D.CnH2n-12(n≥10) |
.25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
| A.12.5% | B.25% | C.50% | D.75% |
化学家们合成了如右图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是()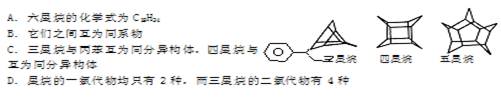
有4种有机物:①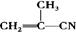 ②
②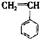 ③
③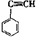 ④CH3-CH=CH-CN,其中可用于合成结构简式为
④CH3-CH=CH-CN,其中可用于合成结构简式为
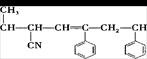
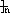 的高分子材料的正确组合为()
的高分子材料的正确组合为()
| A.①③④ | B.①②③ | C.①②④ | D.②③④ |
对下列有机反应类型的认识中,错误的是()