热化学方程式S(l)+O2(g)===SO2(g);ΔH=-293.23 kJ/mol.分析下列说法中不正确的是
| A.S(s)+O2(g)===SO2(g),生成1mol SO2(g), 反应放出的热量小于293.23 kJ |
| B.S(g)+O2(g)===SO2(g),生成1mol SO2(g), 反应放出的热量大于293.23 kJ |
| C.1 mol SO2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和 |
| D.1 mol SO2的键能的总和小于1 mol 硫和1 mol 氧气的键能之和 |
下列叙述正确的是
| A.可用浓硝酸除去铝制品表面的铜镀层 |
B.用催化法处理汽车尾气中的CO和NO:CO+NO C+NO2 C+NO2 |
| C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 |
| D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
有一批做过银镜反应实验的试管要洗涤,可用铁盐溶液来做洗涤剂,因为Fe3+与Ag可发生可逆的氧化还原反应:Fe3+ + Ag Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
| A.FeCl3 | B.Fe2(SO4)3 | C.Fe2(CO3)3 | D.FeCl2 |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的的是
| A.Ca2+、K+、OH−、Cl−、NO3− | B.Fe2+、H+、Br−、NO3−、Cl− |
| C.Na+、K+、SO42−、NO3−、Cl− | D.Al3+、Na+、Cl−、SO42−、NO3− |
如图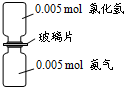 ,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)
,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)
| A.反应前气体反应物的总体积为0.224 L | B.生成物的分子个数为0.005 NA |
| C.产物中的N-H键个数为0.02NA | D.加水溶解后所得溶液中NH4+数目为0.005 NA |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |