1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
| A.-Y kJ/mol | B.-(5X-0.5Y) kJ/mol |
| C.-(10X-Y) kJ/mol | D.+(10X-Y) kJ/mol |
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是 ()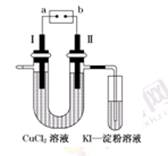
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝 |
| C.可以将惰性电极Ⅰ换为铜棒 |
| D.惰性电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+ |
下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是()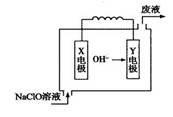
| A.镁作Y电极 |
| B.电池工作时Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为:ClO-+2H2O-4e-= ClO3-+4H+ |
下列各溶液中,微粒的物质的量浓度关系正确的是()
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是()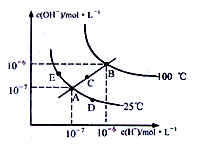
| A.图中五点Kw间的关系:B>C>A=D=E |
| B.C点一定是纯水 |
| C.D点可能是醋酸溶液,E点可能是醋酸钠溶液 |
| D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B.1 mol OH-在电解过程中完全放电时电路中通过了NA个电子 |
| C.铜的电解精炼时,阳极上每转移2mol电子时就溶解铜原子NA个 |
| D.1mol/L的Na2CO3溶液中CO32-粒子数目小于NA |