“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是_________________________________________________。
(2)显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t3的范围为____(填字母)。
A.<22.0 s
B.22.0~44.0 s
C.>44.0 s
D.数据不足,无法判断
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: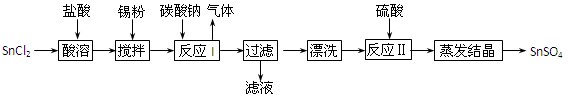
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是,加入Sn粉的作用是。
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:。
(3)检验沉淀已经“漂洗”干净的方法:。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH。已知:Ksp[Sn(OH)2]=1.0×10—26。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是。
③中X试剂为。
(3)⑤的离子方程式为。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有和。
(14分)某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是____和,写出C装置中主要的化学方程式:_________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②____;③_____;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
(14分)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为_________________________________________________。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是______________________________________。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于 饮用水的消毒,其主要原因是___________________________________。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。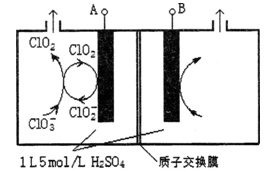
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:________________________、____________________________;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为______________。
(15分)某研究小组利用下图装置探究铜与浓硫酸反应的产物。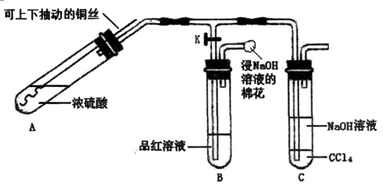
实验步骤与现象如下:
①检查装置气密性,向A中加入5 mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K。
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热。回答下列问题:
(1)溶液中白色固体是_______ (填化学式),C中CCl4的作用是______________。
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝。写出A中可能发生反应的化学方程式:_____________________、_____________________。
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。①分离的操作名称为:______________:②白色沉淀为:______________; ③产生白色沉淀的原因可能是___________________。