高锰酸钾是中学常用的试剂.工业上用软锰矿制备高锰酸钾流程如下.
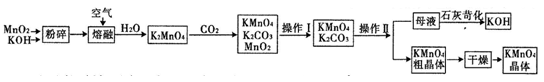
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式 .
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有 、 (写化学式).
(4)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得 mol KMnO4.
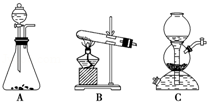
(5)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 ,所需气体产生装置是 (选填代号).
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18.0 g水蒸气液化时的能量变化为44.0 kJ。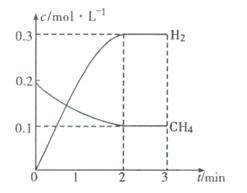
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式。
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
| t/min |
n(CH4)/mol |
n(H2O)/mol |
n(CO)/mol |
n(H2)/mo1 |
| 4 |
0.18 |
0.38 |
0.22 |
0.66 |
则3~4min之间,平衡向(填“正”或“逆”)反应方向移动,3min时改变的条件是。
(3)已知温度、压强和碳水比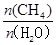 对该反应的影响如图所示。
对该反应的影响如图所示。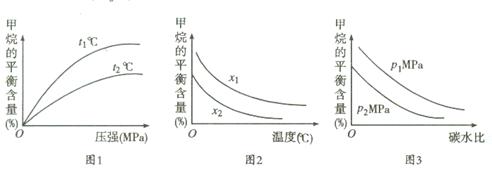
①图1中,两条曲线所示温度的关系:t1t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1x2
③图3中,两条曲线所示压强的关系:p1p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。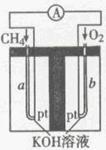
①放电时,正极的电极反应式为
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为。
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如: 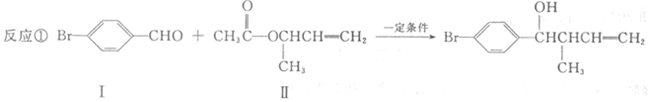
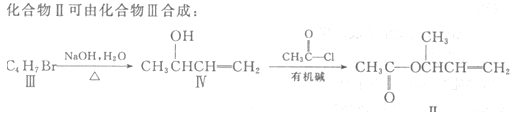
(1)化合物I的分子式为。
(2)化合物Ⅱ与Br2加成的产物的结构简式为。
(3)化合物Ⅲ的结构简式为。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种)。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质之间的转化关系如图所示。
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是。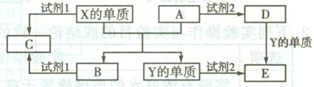
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料为制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是。
某研究性学习小组进行了如下实验探究:将适量1.00 mol·L-1 CuSO4溶液和2.00 mol·L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2.CuSO4]。将9.08 g A隔绝空气在1 000℃左右强热,得到了5.76 g砖红色固体B(铜的+1价氧化物),同时得到的混合气体C;再将5.76 g B溶于过量稀硫酸得到2.56 g另一种红色固体D和蓝色溶液。
(1)实验需用1.00 mol·L-1 CuSO4溶液480ml,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需_________________________;所称取的胆矾固体是____________;配制溶液浓度会导致所配溶液浓度偏高的是_______________
| A.称量质量正确,但胆矾晶体部分失结晶水 |
| B.配制溶液时,定容时仰视容量瓶刻度线 |
| C.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度 |
| D.称量胆矾时把胆矾放在右盘称 |
(2)B与稀硫酸反应的化学方程式为________________________________________。
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是______________。
(4)气体C的成分:__________________________(SO3和SO2不需填)。
(5)通过计算确定A的组成为________________________________________________。
.查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。
试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
(2)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
(3) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2B.Fe C.H2O2D.HNO3
(4)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:_____________________________________________。
(5)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______________________________________。