(1)将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=﹣393.0kJ•mol﹣1综合上述信息,请写出CO完全燃烧的热化学方程式 .
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题: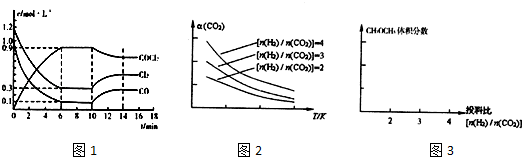
①若保持温度不变,在第8min加入体系中的三种物质各1mol,则平衡 移动(填“向反应正方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)= mol/L,保持反应温度不变则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”、或“=”)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)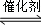 CH3OCH3(g)+3H2O(g).
CH3OCH3(g)+3H2O(g).
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比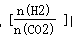 的变化曲线如右上图2.在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比
的变化曲线如右上图2.在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比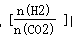 变化的曲线图;
变化的曲线图;
②二甲醚(CH3OCH3)燃料电池可以提升能量利用率.二甲醚酸性介质燃料电池的负极反应式为 .
(4)常温下将amol•L﹣1的醋酸与bmol•L﹣1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则混合溶液中醋酸的电离常数Ka= ( 含a和b的代数式表示)
分子式为C2H6O的化合物A具有如下性质: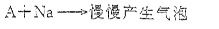
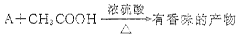
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作。
(3)A与钠反应的化学方程式:。
(4)写出A与CH3COOH反应产生有香味产物的化学方程式:。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡的时间是,理由是。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。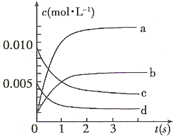
(3)能说明该反应已达到平衡状态的是。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2)d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(11分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述完成下列问题:
(1)元素名称:A_________, B__________, C__________, D_________。
(2)写出B元素在周期表中的位置,第______周期,第________族。
(3)A与B可形成多种化合物,其中会引起温室效应的这一者的电子式为____________
(4)C单质在点燃条件下与B单质充分反应所得固体的化学为______________,该固体化合物类型为_______________,存在的作用力有________________。
(5) 用电子式表示化合物C2D的形成过程_____________________________________。
已知:(X代表卤素原子,R代表烃基)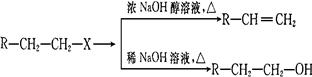
利用上述信息,按以下步骤从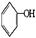 合成
合成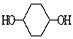 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:___
(4)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)